臨床試験情報
JACCRO PC-01(研究代表者:猪狩功遺)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 切除不能膵癌患者に対するGemcitabine(GEM)単独療法とGemcitabine(GEM)/TS-1併用療法の無作為化比較第II相臨床試験 |
| 研究の目的 | 切除不能膵癌症例を対象にGemcitabine (difluorodeoxycytidine; dFdC、以下GEM)単独療法と GEM/TS-1併用療法の有効性と安全性を明らかにする。 |
| Phase | PhaseⅡ |
| 適格規準 | 1)切除不能な組織学的または細胞診学的に膵癌と診断されている 2)測定可能病変を有する。(10mmスライスCTで20mm以上、5mmスライスで10mm以上) 3)年齢が20歳以上、80歳以下の症例 4)ECOG Performance Status 0-2 5)異時性あるいは同時性の重複癌及び多発癌を有しない症例 但し、治療により取り除かれた上皮内癌あるいは治療後10年経過して治癒と判断できる癌の場合は、適格基準に含まれる 6)疾患に対する前治療(放射線療法、化学療法、免疫療法等)を受けていない症例 但し、胆道ドレナージ術(経皮、経乳頭、開腹)、バイパス術は可とする 7)主要臓器が保持されている症例 ヘモグロビン 8.0 g/dL以上 白血球数 4,000 / mm3以上 好中球数 2,000 / mm3以上 血小板数 100,000 / mm3以上 ALT及びAST 施設内基準値の上限2.5 倍以下 総ビリルビン 2.0mg/dL以下※2 血清クレアチニン 1.5mg/dL以下 SpO2 93%以上 8)投与を不適当と判断される重篤な合併症がない症例 9)腎機能がCcrで60ml/min以上の症例(Cockroft-Gault式からの予測値で可) 10)経口摂取が可能な症例 11)少なくとも8週以上の生存が可能と判断される症例 12)本試験の参加について患者本人及び家族の同意が文書で得られている症例 |
| 除外規準 | 1)CT上明らかである、または臨床症状のある間質性肺炎又は肺線維症を有する症例 2)コントロ-ル困難な糖尿病、肝障害、狭心症及び発症後3ヵ月以内の心筋梗塞を有する症例 3)重症感染症を合併している症例又は発熱があり重症感染症が疑われる症例 4)妊婦、授乳中及び妊娠の可能性又は意思がある症例 5)重篤な薬物アレルギ-を有する症例 6)その他、重篤な合併症を有する症例 7)精神症状を有しており本試験への参加が困難と判断される症例 8)その他、試験担当医師が本研究を安全に実施するのに不適当と判断した症例 |
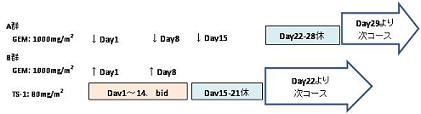
| Regimen |
1.GEM単独群:ゲムシタビン:1000 mg/m2 第1,8,15日を28日を1コースとして、投与中止基準に抵触するまで投与を繰り返す。
|
| 評価項目 | 主評価項目:奏効率 副次評価項目:1年生存率、生存期間中央値(MST)、増悪までの期間(TTP)、安全性、疼痛緩和効果、外来施行率 |
| 目標症例数 | 110例 (GEM群 55例、 GEM/TS-1群 55例) |
| 研究期間 | 2007年 3月より5年間 |