臨床試験情報
JACCRO LC-01(研究代表者:今村文生)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 切除不能ⅢB/Ⅳ期非小細胞肺癌に対するゲムシタビン+カルボプラチン投与法別併用療法のRandomized PhaseⅡstudy |
| 研究の目的 | 切除不能ⅢB/Ⅳ期非小細胞肺癌に対するゲムシタビン(Gemcitabine) とカルボプラチン(Carboplatin) 併用療法のスケジュール別投与方法の有用性を総合的に比較検討し、第Ⅲ相試験のinvestigational armを選択する。 |
| Phase | PhaseⅡ |
| 適格規準 | 1) 組織診または細胞診で非小細胞肺癌と診断された化学療法や生物学的療法を受けていない症例。術後再発症例、評価病変以外への放射線治療例も適格とする。 ・原発巣への放射線治療後の症例も適格とする。ただし放射線治療最終日より3週間以上経過しており、毒性より回復している必要がある。 ・胸水処理後安定症例についても適格とする。ただし胸水処理後より3週間以上経過しており病態が安定している必要がある。 ・心嚢水処理後の患者は不適格とする。 ・胸部または他部位の大手術後の症例も適格とする。ただし2週間以上経過しており、かつ毒性より回復している必要がある。 2) RECISTの規定で測定可能病変を有する症例(10㎜スライスCTで20㎜以上、5㎜スライスCTで10㎜以上等) ・放射線照射を行っていない測定可能病巣が1つ以上必要 3) 根治的放射線治療が適応とならないⅢB・Ⅳ期の症例 4)75歳未満の症例 5) PS(ECOG)0 - 1 6)主要臓器機能が保たれている症例 ・ Neu:1500/mm3以上 ・ PLT:100000/mm3以上 ・ Hb:9.0g/dl以上 ・ GOT/GPT:施設基準値上限の2.0倍以下 ・ T-Bil:1.5mg/dl以下 ・ 血清クレアチニン:施設正常値上限以下、かつクレアチニンクリアランスが50ml/min以上である。 ・ SpO2:95%以上 7)投与開始日より3ヶ月以上の生存が期待される症例 8)告知を受けた研究対象予定患者本人から本研究への参加について文書にて同意が得られた症例 |
| 除外規準 | ① 胸部単純X線写真上明らかな間質性肺炎または肺線維症を有する症例 ② 処置を要する体腔液貯留例 ③ 上大静脈症候群を有する症例 ④ 脳転移症例(ただし安定症例については除外しない。) ⑤ 活動性の重複癌を有する症例 ⑥ コントロール不能な糖尿病を有する症例 ⑦ 重篤な心疾患を有する症例 a. コントロール不良の高血圧症 b. うっ血性心不全 c. 過去6ヶ月以内の不安定狭心症と心筋梗塞の既往歴を有する症例、過去6ヶ月以内のPTCA、CAGBの施行症例 d. 治療を要する心室性不整脈 ⑧ 画像もしくは臨床検査上肝硬変と診断される症例 ⑨ 妊婦、授乳中及び妊娠の可能性または意志のある症例 ⑩ 重篤な薬物アレルギーを有する症例 ⑪ 急性の炎症性疾患を有する症例 ⑫ 輸血等の支持療法に対して同意が得られない症例 ⑬ 臨床上明らかな出血傾向を有する症例 ⑭ その他主治医が本研究を安全に実施するのに不適当と判断した症例 |
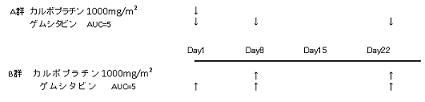
| Regimen |
(A)ゲムシタビン: 1000mg/㎡ 第1、8日、カルボプラチン: AUC 5min×mg/ml 第1日 21日を1コースとして3コース以上、最大6コースまで繰り返す。
|
| 評価項目 | 主要評価項目:有効性(抗腫瘍効果) 副次的評価項目:安全性、全生存期間、投与計画完遂率、Dose intensity |
| 目標症例数 | 60例(各群30例) |
| 研究期間 | 2004年11月から2007年3月 観察期間は1年間 |