臨床試験情報
JACCRO GC-03(研究代表者:藤井雅志)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 進行・再発胃癌患者を対象としたタキソテール®注/ティーエスワンカプセル®併用療法とティーエスワンカプセル®単独療法の第Ⅲ相試験 |
| 研究の目的 | 切除不能・再発胃癌患者を対象として、TS-1/TXT 併用療法とTS-1 単独療法の有効性と安全性を比較検討する。 |
| Phase | PhaseⅢ |
| 適格規準 | ① 20 歳以上、80 歳未満の症例。 ② 組織学的に腺癌の切除不能・進行胃癌である症例(胃食道接合部の腺癌も含む)。 または手術不能の再発症例。 ③ 薬剤の経口摂取が可能な症例。 ④ 明らかな病変(測定可能病変または測定不能病変のいずれか)を有する症例 (RECIST による)(Appendix6 参照) ⑤ ECOG の performance status ≤ 1 の症例。 ⑥ 血色素量(Hb) ≥ 8g/dL、白血球数(WBC)4000~12000/mm3、 血小板数(Pt)≥100,000/mm3 の症例。 ⑦ 血清クレアチニン ≤ 正常域上限 (UNL)の症例。 ⑧ 総ビリルビン ≤ 1.5 ×正常域上限(UNL)の症例。 ⑨ AST/SGOT ≤ 2.5 ×正常域上限(UNL)かつ ALT/SGPT ≤ 2.5 ×正常域上限(UNL)の症例。 ⑩ アルカリフォスファタ-ゼ ≤ 2.5 × 正常域上限(UNL)の症例。 ⑪ 手術の影響が持ち越されていない症例。 ⑫ 前治療として化学療法が施行されていない症例。 ただし、術前または術後補助化学療法の治療終了日から再発まで6 ヶ月以上経過しており、本試験の登録日に前治療による副作用が持ち越されていない症例は登録可とする。 ⑬ 3 ヶ月以上の生存が期待できる症例。 ⑭ 文書による同意が得られている症例。 |
| 除外規準 | ① 活動性の重複癌(大腸の早期癌は除く)を有する症例。 ② 活動性の消化管出血のある症例。 ③ 排液を要する大量の腹水症例。 ④ 脳転移症例。 ⑤ Grade 2*以上の症状のある末梢神経障害を有する症例。* NCI-CTCAE v.3.0 に則る。 ⑥ 肺線維症、間質性肺炎症例。 ⑦ 5-FU、TXT およびポリソルベート80 に対して過敏症の既往歴のある症例。 ⑧ 進行再発胃癌に対する治療として化学療法または放射線療法を施行された症例。 ⑨ 妊婦または授乳婦、及び試験期間中に妊娠する意思のある女性及び妊娠させる 意思のある男性。 ⑩ 試験参加までの4 週間以内に他の治験薬による臨床試験に参加している症例。 ⑪ コルチコステロイドの使用が禁忌の症例。 ⑫ その他、研究責任者または研究担当者によって試験への参加が不適当と判断された症例。 |
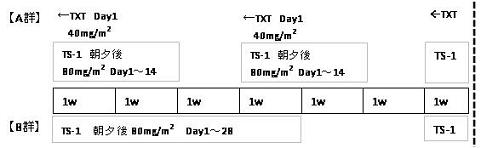
| Regimen |
多施設、多国籍共同のプロスペクティブ無作為化比較第Ⅲ相オープン試験である。被験者は無作為に3 週間を1 サイクルとするA 群(TXT/TS-1 併用)と6 週間を1 サイクルとするB 群(TS-1単独)に割り付けられる。
|
| 評価項目 | 主要評価項目:進行・再発胃癌患者に対するTS-1 単独群とTXT/TS-1 併用群の生存期間中央値[登録年月日~死亡年月日](MST)。 副次評価項目 • 増悪までの期間(TTP):試験登録後、病態の進行(PD)がみられるまでの期間の比較。 • 奏効率:RECIST ガイドラインよって評価されたCR とPR の和の比較 • 安全性の比較 |
| 目標症例数 | 628 例(片群314 例) |
| 研究期間 | 2005 年 9 月より5 年間 |