臨床試験情報
JACCRO CC-13(研究代表者:辻 晃仁)
| 項目 | 説明 |
|---|---|
| 試験課題名 | RAS野生型進行大腸癌患者におけるFOLFOXIRI+セツキシマブとFOLFOXIRI+ベバシズマブの最大腫瘍縮小率(DpR)を検討する無作為化第Ⅱ相臨床試験 |
| 研究の目的 | RAS野生型切除不能進行・再発大腸癌を対象として、FOLFOXIRI+ベバシズマブ併用療法に対するFOLFOXIRI+セツキシマブ併用療法の優越性を検証する。 |
| Phase | PhaseⅡ |
| 適格規準 | (1) 組織学的に大腸癌であることが確認された症例 (2) RAS野生型の切除不能進行・再発大腸癌の症例 (3) RECISTに基づく測定可能病変を有する症例(RECIST Ver.1.1) (4) 切除不能の原発巣、及び切除不能の遠隔転移またはリンパ節転移の場合は、前治療として化学療法を行っていない症例(手術を施行した場合、手術以外の治療を行っていないこと) 再発例の場合は、原発巣または転移巣に対する手術後の初回再発であり、その再発巣に対しては手術療法も含め治療を行っていない症例(術後補助療法施行例は治療終了12か月以上経過して再発した症例) (5) 同意取得時の年齢が20歳以上の症例 (6) ECOGのPerformance Status(PS)が0~1の症例、ただし71歳以上の場合はPS0の症例 (7) 6か月以上の生存が見込まれる症例 (8) 登録前14日以内の主要臓器機能について、以下の規準を満たしている症例。 なお、当該期間内に検査結果が複数存在する場合は登録直近のものを採用することとし、測定にあたっては検査日前14日以内に輸血、造血因子製剤等の投与は行わない。 1) 白血球数 3,000/mm3以上、12,000/mm3未満 2) 好中球数 1,500/mm3以上 3) 血小板数 10.0×104/mm3以上 4) ヘモグロビン 9.0g/dL以上 5) 血中ビリルビン 施設基準値上限の1.5倍以下 6) AST 施設基準値上限の2.5倍以下(肝転移を有する場合は5倍以下) 7) ALT 施設基準値上限の2.5倍以下(肝転移を有する場合は5倍以下) 8) 血清クレアチニン 施設基準値上限の1.5倍以下 9) 蛋白尿 1+以下 10) PT-INR 1.5以下 (9) 本試験内容について十分な説明を受け、本人の文書による同意が得られている症例 |
| 除外規準 | 以下の規準のいずれかに該当する症例は、本試験から除外する。 (1) 同時性重複がんまたは無病期間が5年以内の異時性重複がんを有する症例(ただし局所治療で治癒が見込める早期がんは除外とはしない) (2) 家族歴他から、遺伝性大腸がんが疑われる症例 (3) 脳転移を有する症例 (4) 感染症を有する症例 (5) 間質性肺炎あるいは肺線維症を有する症例 (6) 重篤な心疾患またはその既往歴を有する症例 (7) 血栓塞栓症の既往歴を有する症例 (8) 脳血管障害を有する症例 (9) 吐血、喀血の既往歴を有する症例 (10) コントロール不十分な高血圧症例 (11) 機能障害を伴う重度の感覚異常または知覚不全のある症例 (12) 多量の癌性体腔液(胸水、腹水、心嚢水)を有する症例 (13) 重篤な併存疾患(腎不全、肝不全、高血圧など)を有する症例 (14) 原発巣または転移巣に対して放射線治療が施行された症例 (15) 避妊する意思のない男性。または妊婦、授乳婦、妊娠検査陽性の女性または避妊する意思のない女性 (16) 重篤な過敏症の既往を有する症例 (17) HBsAgが陽性である症例または活動性のウイルス性肝炎を有する症例 (18) 登録前14日以内に輸血、血液製剤およびG-CSF等の造血因子製剤の投与を行った症例 (19) 登録前28日以内に手術療法、切開を伴う生検、外傷に対する縫合処置を実施している、あるいは7日以内に穿刺吸引細胞診を実施している症例(中心静脈ポート処置は除く) (20) 関節リウマチ等の慢性的な炎症性疾患のため、血小板機能を抑制する薬剤(1日325mg以上のアスピリン製剤あるいは非ステロイド抗炎症薬)の投与が必要あるいは投与中である症例 (21) 出血傾向(喀血、あるいは画像所見で肺転移巣の空洞化又は/及び壊死が認められる場合も含む)、凝固障害あるいは凝固因子異常がある症例 (22) 消化管穿孔を有する症例あるいは登録前1年以内に既往を有する症例 (23) 未治癒の外傷性骨折を有する症例 (24) 水様便、またはコントロール不能な下痢を有する症例 (25) 免疫抑制剤を要する臓器移植の既往を有する症例 (26) これまでにセツキシマブ、ベバシズマブ、オキサリプラチン、あるいはイリノテカンの投与を行ったことがある症例(術後補助化学療法としてのオキサリプラチン投与は除く) (27) 硫酸アタザナビル(レイアタッツ)を投与している症例 (28) 黄疸のある症例 (29) 腸管麻痺、腸閉塞のある症例 (30) その他、試験責任医師または分担医師が本試験への参加を不適当と認められた症例 |
| Regimen |
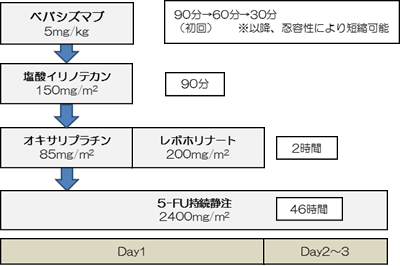
A群:FOLFOXIRI+ベバシズマブ併用療法
下記のいずれかに該当する場合、FOLFOXIRI+ベバシズマブ併用療法から5-FU+レボホリナート+ベバシズマブ療法に移行する。
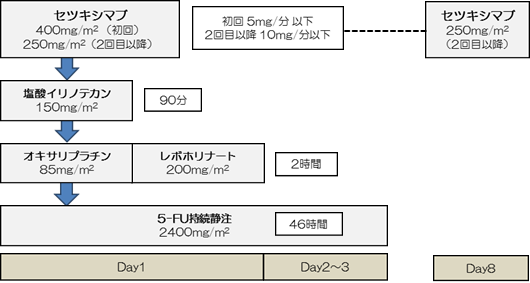
下記のいずれかに該当する場合、FOLFOXIRI+セツキシマブ併用療法から5-FU+レボホリナート+セツキシマブ療法に移行する。 |
| 評価項目 | 主要評価項目:最大腫瘍縮小率(DpR:Deepness of Response)※ ※最大腫瘍縮小率(DpR:Deepness of Response)は、RECIST規準における標的病変の直径の総和を算出し、増悪が無い状況下でベースラインの総和から最も縮小した時の総和を減じた数値を、ベースラインの総和で除したものとする。 副次評価項目:8週時点の早期腫瘍縮小率(ETS:Early Tumor shrinkage) 奏効率(RR:Response Rate) 4か月時点までの最大腫瘍縮小率(DpR:Deepness of Response) 治療成功期間(TTF:Time to Treatment Failure) 腫瘍増殖までの期間(TTG:Time to Tumor Growth) 無増悪生存期間(PFS:Progression-Free Survival) 全生存期間(OS:Overall Survival) 腫瘍縮小(ETS、RR、DpR)と予後(PFS、OS)との相関 TTGと予後(OS)との相関 切除率(Resection rate) R0切除率(R0 resection rate) 安全性(有害事象発現割合およびその重症度) |
| 目標症例数 | 各群180例、合計360例 |
| 研究期間 | 登録期間:2015年7月~2019年6月(4年間) 追跡期間:最終症例登録終了後3年間 試験期間:2015年7月~2022年6月(7年間) |