臨床試験情報
JACCRO CC-02(研究代表者:市川度)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 進行・再発大腸癌に対するOxaliplatin+5-FU/ℓ-LV療法(FOLFOX4法)の第Ⅱ相臨床試験 |
| 研究の目的 | 進行・再発大腸癌を対象として、FOLFOX4法の有効性と安全性を確認する。 |
| Phase | PhaseⅡ |
| 適格規準 | (1) 組織学的に腺癌、粘液癌、印環細胞癌であることが確認されている結腸・直腸癌 (2) 治癒切除不能な進行・再発結腸・直腸癌 (3) A群:進行再発病巣に対して化学療法未治療例 B群:進行再発病巣に対して、L-OHPによる前治療歴のない症例で、CPT-11を必ず含む1レジメン以内の化学療法歴を有する症例。ただし、前治療終了日から4週間以上経過していることとする。 A群、B群共に、フッ化ピリミジン系抗癌剤による術後補助療法がある場合は、フッ化ピリミジン系抗癌剤の最終投与から2週間経過していることとする。 (4) RECISTに基づく測定可能病変を有する症例 (5) 12週間以上の生存が期待できる症例 (6) 登録時の年齢が20歳以上、80歳以下の症例 (7) Performance Status(ECOG scale)(別冊:Ⅳ)が0~2である症例 (8) 登録前7日以内のデータにより、以下の骨髄・肝・腎機能を有する症例 ヘモグロビン: 9.0 g/dL以上 白血球数: 施設基準値下限~12,000 /mm3 好中球数: 1,500 /mm3以上 血小板数: 100,000 /mm3以上 血清総ビリルビン: 施設基準値上限の1.5倍以下 血清AST(GOT)・血清ALT(GPT): 施設基準値上限の2.5倍以下*1 血清ALP: 施設基準値上限の2.5倍以下*1 血清クレアチニン: 施設基準値上限以下 (9)本治療の被験者となることを本人より文書にて同意が得られている症例 |
| 除外規準 | (1) 活動性の重複がんを有する症例 (2) 薬剤過敏症(フルオロウラシル、白金製剤を含む)の既往歴のある症例 (3) CPT-11またはL-OHPを含む補助化学療法が施行された症例 (4) 原発巣または転移巣に対して放射線治療が施行された症例 (5) 活動性の感染症を有する症例(発熱38.0℃以上) (6) 重篤な合併症(腸管麻痺、腸閉塞、間質性肺炎または肺線維症、コントロールが困難な 糖尿病、心不全、腎不全、肝不全など)を有する症例 (7) 多量のがん性体腔液(胸水、腹水、心嚢水)貯留症例 (8) 脳転移を有する症例 (9) 下痢(水様便)のある症例、ただし、人工肛門造設例においては日常生活に支障のある 下痢を有する症例 (10) 機能障害を伴う重度の感覚異常または知覚不全のある症例 (11) テガフール・ギメラシル・オテラシルカリウム配合剤投与中の患者および投与中止後7日以内の症例 (12) 妊娠中、妊娠している可能性がある症例 (13) その他主治医が本試験を安全に実施するのに不適当と判断した症例 |
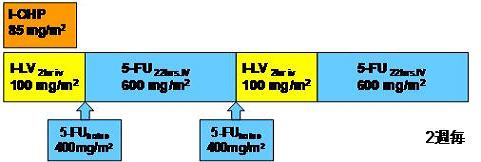
| Regimen |
第1、2日目に下記の通り、試験薬の投与を行い、12日間休薬する。2週(14日間)を1サイクルとして、プロトコール治療の中止基準に該当しない限り治療を継続する。サイクル数の上限は設定しない。
|
| 評価項目 | 主要評価項目: 奏効率 (response rate) 副次的評価項目: 薬物有害反応(副作用)(発現率およびその重症度)、生存期間 (OS: overall survival)、無増悪期間 (TTP: time to progression)、治療成功期間 (TTF: time to treatment failure) |
| 目標症例数 | A群:1st-line 60例、B群:2nd-line 60例 |
| 研究期間 | 2006年3月~2010年2月 |