臨床試験情報
JACCRO GY-01(研究代表者:瀧澤 憲)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 局所進行子宮頸癌に対するCDDP+PTXのweekly 投与を併用するConcurrent Chemoradiotherapy(同時的化学放射線療法)の有用性に関する多施設共同第II相試験 |
| 研究の目的 | 遠隔転移のない、切除不能と判断される局所進行(IIIa~IVa期)子宮頸癌に対する、我が国の標準的放射線治療スケジュールとCDDP 30mg/m2 +PTX 50mg/m2 weekly 投与を用いたCCRTの有効性と安全性を評価する |
| Phase | Phase II |
| 適格規準 | 1) 原発巣が子宮頸癌(扁平上皮癌、腺扁平上皮癌、腺癌)であることが組織学的に確認されている患者 2) 一般状態(ECOG Performance Status, PS)が0または1の患者 3) 登録時の年齢が20歳以上70歳以下の患者 4) FIGO臨床病期(1994年)Ⅲa,IIIb,Ⅳa期の患者であり、登録前4週間以内のCTにおいて10mm以上の傍大動脈リンパ節の腫大を認めない患者 5) 子宮頸癌に対し放射線治療、化学療法、手術の前治療歴がない患者 6) 主要臓器(骨髄、心、肝、腎など)の機能が保持されている患者 登録前14日以内に検査されていること - 好中球数 2,000/mm3以上 - ヘモグロビン 10g/dl以上(輸血による補正を許容) - 血小板数 10万/mm3以上 - 総ビリルビン値 1.5mg/dL以下 - AST(GOT)、およびALT(GPT) 100IU/L以下 - 血清クレアチニン値 1.2mg/dL以下 - クレアチニン・クリアランス(Modified Jelliffe式*) 50.0mL/min以上 登録前28日以内に検査されていること - 心電図 正常または治療を要さない程度の変化 7) 本試験の参加について文書による同意が本人より得られている患者 |
| 除外規準 | 1) 断端癌患者 2) 活動性の感染症(38.5℃以上の発熱を有し、画像診断もしくは細菌学的検査にて細菌感染が証明されている)を有する患者 3) 水腎症を有する患者(ただし、腎ろう増設や尿路ステント留置等の処置がおこなわれている患者は、登録可能) 4) 登録前6ヵ月以内の心筋梗塞、不安定狭心症、コントロール不良の不整脈を有する患者 5) 重篤な合併症(コントロール不良な高血圧や糖尿病、出血傾向、ステロイド投与を要する膠原病等)を有する患者 6) 骨盤部に放射線治療歴を有する患者 7) 活動性の重複がん(同時性重複がん及び無病期間が5年以内の異時性重複がん)を有する患者。ただし局所治療により治癒と判断されるCarcinoma in situ(上皮内癌)または粘膜内癌相当の病変は活動性の重複がんに含めない 8) 子宮頸癌に対し試験開腹が行われた患者 9) 精神病または精神症状を合併しており試験への参加が困難と考えられる患者 10) 妊娠中あるいは妊娠の可能性のある、または授乳中の患者 11) 子宮留膿症が認められた場合、適切な処置を行っても子宮留膿症や感染の改善が認められない患者(子宮壁が菲薄化している場合は穿孔の危険があり特に注意が必要) 12) その他、担当医師が不適当と判断した場合 |
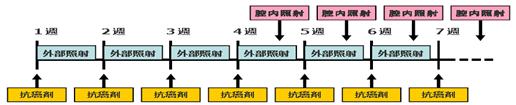
| Regimen |
♦放射線療法:外部照射と高線量率腔内照射(High-dose-rate intracavitary brachytherapy: HDR-ICBT)の併用中央遮蔽挿入前の外部照射合計線量と、HDR-ICBTの合計A点線量のBiologically effective dose (BED)の合算は74-78Gy10 1) 外部照射: 全骨盤照射50-50.4Gy/25-28回(中央遮蔽30-41.4Gyより) 2) HDR-ICBT: A点線量一回6Gy, 計3-4回= BED 74-78Gy10相当
|
| 評価項目 | 1) Primary endpoint: 2年無増悪生存割合 2) Secondary endpoints: ① 治療完遂割合(化学療法、放射線療法) ② 有害事象のGrade別発現率(早期、晩期) ③ 完全奏効(CR)割合 ④ 2年生存割合 ⑤ 2年骨盤内無増悪割合 ⑥ 2年遠隔転移発生割合 |
| 目標症例数 | 70例 |
| 研究期間 | 2009年12月~2014年1月 |