臨床試験情報
JACCRO GC-11(研究代表者:新井 裕之)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 術後補助化学療法中または終了後早期に再発した胃癌に対するCapeOX+ニボルマブ療法の第Ⅱ相試験(FirSTAR試験) |
| 研究の目的 | S-1療法またはDS療法による術後補助化学療法中または終了後早期に再発したHER2陰性胃癌の症例を対象にCapeOX+ニボルマブ療法の有効性を検討する。 |
| Phase | PhaseⅡ |
| 適格規準 | 以下の規準を全て満たす症例を適格とする。 (1) 組織学的に胃(食道胃接合部を含む)の腺癌(乳頭腺癌、管状腺癌、低分化腺癌)、印環細胞癌、粘液癌、肝様腺癌、リンパ球浸潤癌のいずれかと診断されている症例 (2) D2またはD3郭清を伴う標準的手術によるR0切除後(pStageⅡまたはⅢ、ypStageⅡまたはⅢも含む)にS-1またはDS療法による補助化学療法を12週(84日)以上(治療開始~最終投与日までの期間)行い、補助化学療法中または最終投与日から6か月以内の再発が画像診断にて証明されている症例 (3) 同意取得時の年齢が18歳以上である症例 (4) ECOGのPerformance Status(PS)が0~1である症例 (5) HER2陰性である症例 (6) RECIST Ver.1.1に基づく測定可能病変を有する症例 (7) 経口摂取が可能である症例 (8) 再発胃癌に対する化学療法または放射線治療の治療歴がない症例 (9) 登録前7日以内の主要臓器機能について、以下の規準を満たしている症例 1) 白血球数 12,000/mm3以下 2) 好中球数 1,500/mm3以上 3) ヘモグロビン 8.0g/dL以上 4) 血小板数 10.0×104/mm3以上 5) 総ビリルビン 2.0mg/dL以下 6) クレアチニンクリアランス 50mL/min以上* *Cockcroft-Gault式による推定値で50mL/min/body以上であること。推定値で 50mL/min/body未満の場合、実測値で50mL/min/body以上であることが確認されれば適格とする。 [Cockcroft-Gault式] CCr:クレアチニンクリアランス(mL/分) 男性:CCr={(140-年齢)×体重(kg)}/{72×血清クレアチニン値(mg/dL)} 女性:CCr=0.85×{(140-年齢)×体重(kg)}/{72×血清クレアチニン値(mg/dL)} 7) AST 100 IU/L以下(肝転移を有する場合は150 IU/L以下) 8) ALT 100 IU/L以下(肝転移を有する場合は150 IU/L以下) (10) 本研究内容について十分な説明を受け、本人の文書による同意が得られている症例 |
| 除外規準 | 以下の規準のいずれかに該当する症例は、本研究から除外する。 (1) 免疫チェックポイント阻害薬を用いた薬物療法の前治療歴がある症例 (2) 登録前14日以内に抗癌薬の投与を受けている症例 (3) 術前のプラチナ製剤を含む補助化学療法または補助化学放射線療法に不応である症例 (4) 活動性の重複癌(同時性重複がんまたは無病期間が5年以内の異時性重複癌、ただし局所治療により治癒と判断される上皮内癌や粘膜内癌相当の病変は活動性の重複癌に含めない)の症例 (5) 全身的治療を要する感染症を有する症例 (6) 活動性の自己免疫疾患がある症例 (7) 登録前28日以内に体腔液排除を必要とする多量の胸水、腹水、または心嚢液貯留を認めている症例(ただし、検査目的のための体腔液採取は除外としない) (8) Grade2以上の末梢性感覚ニューロパチー、末梢性運動ニューロパチーの合併がある症例 (9) 避妊する意思のない男性/女性、妊娠中または妊娠の可能性がある、または授乳中の女性 (10) 症状を有する中枢神経系(脳、脊髄、髄膜)への転移がある症例 (11) 重篤な合併症(心不全、腎不全、肝不全、腸管麻痺、腸閉塞、コントロール不良の糖尿病など)を有する症例 (12) 間質性肺炎または肺線維症を合併している症例 (13) 不安定狭心症(登録前3週間以内に発症または発作が増悪している狭心症)を合併、または6か月以内の心筋梗塞の既往を有する症例 (14) 精神障害または精神症状を合併しており、本研究への参加が困難と判断される症例 (15) ステロイド薬またはその他の免疫抑制薬の継続的な全身投与(内服または静脈内)を受けている症例 (16) フェニトイン、ワルファリンカリウムのいずれか、もしくは両者の継続使用が必要である症例 (17) 薬物アレルギー等の理由により、ヨード系薬剤、ガドリニウム系薬剤の両者とも使用できない症例 (18) その他、研究責任医師または研究分担医師により本研究の対象として不適当と判断される症例 |
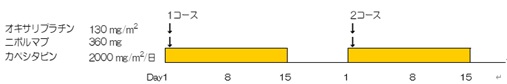
| Regimen |
投与薬剤・投与量・投与方法
|
| 評価項目 | 主要評価項目:客観的奏効割合 副次評価項目:全生存期間、無増悪生存期間、病勢制御割合、奏効期間、有害事象の発生割合 |
| 目標症例数 | 92例 |
| 研究期間 | 登録期間:2023年3月~2025年8月(2.5年) 追跡期間:最終症例登録終了後1.5年間 解析期間:追跡期間終了後0.5年 総研究期間:2023年3月~2027年8月(4.5年) |