臨床試験情報
JACCRO GC-07(研究代表者:小寺 泰弘、吉田 和弘)
| 項目 | 説明 |
|---|---|
| 研究課題名 | StageⅢの治癒切除胃癌に対する術後補助化学療法としてのTS-1+Docetaxel併用療法とTS-1単独療法のランダム化比較第Ⅲ相試験(JACCRO GC-07:START-2) |
| 研究の目的 | StageⅢの治癒切除胃癌を対象とし、TS-1+Docetaxel併用療法のTS-1単独療法に対する術後補助化学療法としての優越性を検証する。 |
| Phase | PhaseⅢ |
| 適格規準 | 以下の条件を全て満たす症例を対象とする。 (1) 組織学的に確診されたStageⅢA、ⅢB、ⅢC(病理分類)の一般型(Common Type)胃癌症例。 (2) D2リンパ節切除を受けた症例のうち、癌の遺残が認められないR0手術例。ただし、胃全摘術を施行し、脾摘を伴わなかった症例(リンパ節No10の郭清を省略した症例)も適格とする。 (3) 肝転移、腹膜転移および遠隔転移がなく、腹腔洗浄細胞診が陰性の症例。 (4) 登録時年齢が20歳以上80歳以下の症例。 (5) PS(ECOG)が0あるいは1である症例。 (6) 原疾患に対する手術後6週以内(手術日を0日として、手術後42日以内)の症例。 (7) 経口投与可能な症例。 (8) 対象疾患に対して手術以外の前治療(放射線療法、化学療法など)が行われていない症例。 (9) 登録前14日以内(登録日2週間前の同一曜日の検査は可)の臨床検査により主要臓器機能が保持されている症例。 ① 白血球数:施設基準値下限あるいは4,000/mm3以上 12,000/mm3以下 ② 好中球数:1,500 /mm3以上 ③ 血小板数:10.0×104 /mm3以上 ④ ヘモグロビン:9.0 g/dL以上 ⑤ 血中ビリルビン:1.5 mg/dL以下 ⑥ AST:100 IU/L以下 ⑦ ALT:100 IU/L以下 ⑧ 血清クレアチニン:1.2 mg/dL以下 ⑨ クレアチニンクリアランス:50 mL/min以上 (10) 患者本人から文書による同意が得られている症例。 |
| 除外規準 | 以下の規準のいずれかに該当する症例は、本試験から除外する。 (1) 同時性、異時性の重複がん/多発がんを有する症例。ただし、以下の場合は適格とする。 ・同時性、異時性の重複がんであっても、子宮頸癌のcarcinoma in situの場合あるいは大腸癌のfocal cancer in adenomaの場合 ・異時性多発がん(胃癌の既往)であっても、既往病変が「胃癌治療ガイドライン【第3版】」に従った適応条件を満たし、内視鏡的粘膜切除が行われていた場合 (2) 重篤な術後合併症(重篤な術後感染症、縫合不全、消化管出血など)を有する症例。 (3) 重篤な合併症(腸管麻痺、腸閉塞、間質性肺炎または肺線維症、コントロールが困難な糖尿病、コントロール不良の高血圧症、心不全、腎不全、肝硬変、肝不全など)を有する症例。 (4) 活動性の感染症を有する症例。【Docetaxelの投与禁忌】 (5) HBs抗原陽性またはHCV抗体陽性の症例。 (6) ステロイド剤の継続的な全身投与(内服または静脈内)をうけている症例。 (7) 下痢(水様便)を有する症例。 (8) 重篤な薬物アレルギーを有する症例。 (9) 薬物アレルギーにより、ヨード系薬剤、ガドリ二ウム系薬剤の両者とも使用できない症例。 (10) フルシトシンを服用中である症例。【TS-1の投与禁忌】 (11) ワルファリンカリウムの内服を必要とする症例。 (12) 妊婦あるいは妊娠している可能性のある女性、パートナーの妊娠を希望する男性。 (13) その他、試験責任医師または分担医師が本試験の登録には不適当と判断した症例。 |
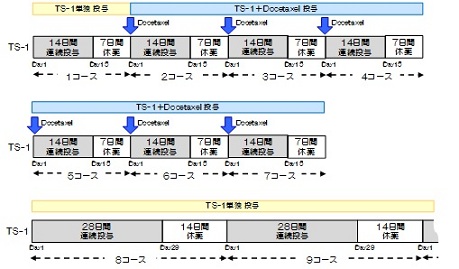
| Regimen |
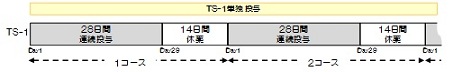
手術後6週以内(手術日を0日として、手術後42日以内)にプロトコール治療を開始する。
TS-1を朝食後・夕食後に28日間連日投与し、その後14日間休薬する。これを1コースとし、手術1年後まで繰り返す。なお、各コースは28日を超えての連日投与は行わない。また、手術後1年間経過した後は新たなコースに入らないこととする。
|
| 評価項目 | 主要評価項目:3年無再発生存期間(RFS:Relapse-Free Survival) 副次評価項目:3年、5年全生存期間(OS:Overall Survival) 5年無再発生存期間(RFS) 治療成功期間(TTF:Time to Treatment Failure) 有害事象の発生割合 |
| 目標症例数 | 1100例(1群あたり550例) |
| 研究期間 | 登録期間:2013年4月~2017年12月(4.75年間) 観察期間:最終症例登録後5年間 試験期間:2013年4月~2022年12月(9.75年間) |