臨床試験情報
JACCRO GC-05(研究代表者:藤井 雅志(日本大学))
| 項目 | 説明 |
|---|---|
| 試験課題名 | 初回TS-1療法に治療抵抗性を示した進行・再発胃癌に対する二次化学療法 ― CPT-11単独療法 vs TS-1+CPT-11併用化学療法の無作為化比較第Ⅱ/Ⅲ相臨床試験 ― |
| 研究の目的 | TS-1単独療法に治療抵抗性を示した、あるいはCPT-11併用を除くTS-1+α併用療法に対して治療抵抗性を示した治癒切除不能進行・再発胃癌二次治療対象症例を対象に、無作為化比較第Ⅱ/Ⅲ相試験にてTS-1+CPT-11併用療法群とCPT-11単独群の全生存期間を比較検討する。 |
| Phase | 無作為化比較第Ⅱ/Ⅲ相臨床試験(オープンラベル) |
| 適格規準 | (1) 病理組織学的に胃癌であることが確認されている症例 (2) 薬剤の経口摂取が可能な症例 (3) 切除不能または再発胃癌に対する初回化学療法としてTS-1単独療法ないしはTS-1+α併用療法による前治療が施行されており、試験責任医師または試験分担医師により、以下の①、②のいずれかに判定された症例 ① TS-1単独療法ないしはTS-1+α併用療法を施行し、奏効を認めることなく(SD・PD・NE)、画像診断でPDが確認された症例 ② TS-1単独療法ないしはTS-1+α併用療法を施行し、一度奏効(CR・PR)を認めたものの再燃し、画像診断でPDが確認された症例 (4) 画像診断でPDが確認されてから登録まで4週間以内の症例(ただし画像PD確認から投与開始まで4週間以上経過する時は再度画像診断を実施すること。) (5) TS-1の総量が、TS-1単独投与では2240 mg/m2以上(80 mg/m2 x 4Wに相当)、TS-1+α併用療法では1680 mg/m2以上(80 mg/m2 x 3Wに相当)投与された症例 (6) Performance status(ECOG分類:別冊IV): 0~1である症例 (7) 登録時の満年齢が20歳以上の症例 (8) 投与開始日より12週以上の生存が期待される症例 (9) 重度の臓器不全がない症例。即ち、登録前7日以内に実施した臨床検査が以下のすべての規準を満たす症例。 【血液学的検査値】 ・白血球数 ≧ 4,000/mm3、かつ≦ 12,000mm3 ・好中球数 ≧ 2,000/mm3 ・血小板数 ≧ 100,000/mm3 ・ヘモグロビン ≧ 8.0g/dl 【肝機能検査値】 ・AST(GOT)、ALT(GPT)≦100IU/L ・総ビリルビン ≦1.50mg/dL 【腎機能検査値】 ・血清クレアチニン ≦ 施設基準上限値 かつ実測または計算式(Cockcroft-Gaultの式による)により推定された クレアチニンクリアランスが >60 ml/min であること。 (10)本試験登録前に被験者本人による署名、日付が記載された同意書が得られている症例 |
| 除外規準 | (1)初回化学療法としてTS-1+CPT-11併用療法が施行されている症例 (2)初回化学療法としてTS-1単独療法ないしはTS-1+α併用療法以外の化学療法剤、免疫療法剤または放射線療法(疼痛コントロールのための局所照射を含む)による治療のある症例 (3)再発胃癌症例においては、術後補助療法としてTS-1単独療法ないしはTS-1+α併用療法による治療歴のある症例 * 術後再発後の化学療法としてTS-1単独療法ないしはTS-1+α併用療法を行った症例は対象とする。 (4)既に進行・再発胃癌に対する何らかの初回治療および二次治療が実施され、今回が三次治療となる症例 (5)本試験の登録前7日以内に、輸血、血液製剤およびG-CSF等の造血因子製剤の投与を受けている症例 (6)初回化学療法であるTS-1単独療法ないしはTS-1+α併用療法を薬物有害反応により中止した症例 (7)本試験使用薬剤に対して重篤な薬物過敏症、あるいは重篤な薬物アレルギーの既往を有する症例 (8)排液を要する腹水または胸水を有する症例 (9)臨床上問題となる感染症を合併している症例、または発熱を有し、感染症が疑われる症例 (10)下痢を有する症例 (11)腸管麻痺、腸閉塞を有する症例 (12)重度の肺疾患(間質性肺炎、肺線維症、高度の肺気腫等)を有する症例 (13)フッ化ピリミジン系抗悪性腫瘍剤(TS-1を除く)を投与中の症例 (14)フルシトシン(アンコチル)を投与中の症例 (15)硫酸アタザナビル(レイアタッツ)を投与中の症例 (16)脳転移を有する症例※1 ※1 症状がない場合には、画像検索により脳転移の有無が確認されていなくても登録可とする。ただし、脳転移を有することが登録前に明らかとなっていた場合には、症状がなくても登録不可とする。 (17)活動性の重複癌を有する症例※2 ※2 活動性の重複癌とは、同時性重複癌および無病期間が5年以内の異時性重複癌であり、局所治療により治癒と判断されるcarcinoma in situ(上皮内癌)もしくは粘膜内癌相当の病変は活動性の重複癌に含めない。 (18)コントロール困難な糖尿病を有する症例 (19)臨床上問題となる心疾患(うっ血性心不全、症候性冠動脈疾患、コントロール不良な不整脈、過去12ヶ月以内に発症した心筋梗塞の既往等)を合併する症例を有する症例 (20)臨床上問題となる中枢神経障害のある症例 (21)臨床上問題となる精神・神経疾患等により、本試験の登録が困難と判断された症例 (22)老人性痴呆症を有する症例 (23)消化管の新鮮出血を有する症例 (24)妊婦、授乳婦及び妊娠の可能性(意思)のある女性、および挙児を希望する男性 (25)その他、試験責任医師または試験分担医師などが本試験を安全に実施するのに不適当と判断した症例 |
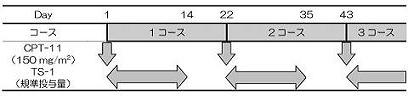
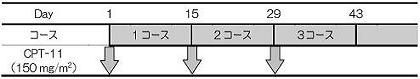
| Regimen |
1)TS-1+CPT-11併用療法群(A群)
2)CPT-11単独投与群(B群)
|
| 評価項目 | 主要評価項目:ⅰ)第II相部分:二次治療開始から6週間後のPD率 ⅱ)第III相部分:登録日からの全生存期間(OS) 副次評価項目:ⅰ)薬物有害反応:発現率およびその重症度 ⅱ)抗腫瘍効果(奏効率):標的病変を有する症例のみ ⅲ)無増悪生存期間(PFS) ⅳ)治療成功期間(TTF) ⅴ)後治療(3rd line)移行率:治療内容も含む |
| 目標症例数 | 第Ⅱ相部分:60例(A群30例、B群30例) 第Ⅲ相部分:300例(A群150例、B群150例):第Ⅱ相部分も含む |
| 研究期間 | 症例集積期間:平成20年2月~平成22年3月(目標症例数に達しない場合は試験期間を延長する) 研究期間:平成20年2月~平成25年9月 |