臨床試験情報
JACCRO GC-02(研究代表者:坂田優)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 進行・再発胃癌患者を対象としたTS-1とTaxotereの併用化学療法の検討 |
| 研究の目的 | 切除不能・再発胃癌を対象として、TS-1とDocetaxelの併用試験のPhase I, II試験を行い併用療法の有害事象、推奨用量の設定、ならびに有効性を評価する。 |
| Phase | PhaseⅠ、Ⅱ |
| 適格規準 | 1)対象本試験の被験者となることが本人より文書で同意が得られている症例。 2)胃癌であることが組織診で確認されており、測定可能病変(遠隔CTでは2cm、ヘリカルCTではスライス幅の2倍以上の長径)が客観資料(全ての資料が初回投与の28日以内のもの)で確認されている症例。 3)外科的根治手術不能な進行・再発胃癌の症例。 4)前治療(化学療法、放射線療法等)が実施されていない症例、又は前治療(外科手術、化学療法、放射線療法等)の影響が持ち越されていない症例。 (1)化学療法は 1 regimen までとする。ただし、終了後6ヶ月以上経過している。術後補助化学療法は1 regimen に算定しない。 (2)前治療終了後28日以上経過していること。ただし、代謝拮抗剤、免疫療法剤の投与の場合は7日以上(MMCの場合は6週間とする)経過している症例に限り対象とする。 5)登録前14日以内の測定データにより以下の骨髄・肝・腎機能を有する症例。 ・血色素量 :8.0g/dl以上 ・白血球数 :3500~12000/㎣ ・好中球数 :1500/㎣以上 ・血小板数 :10×104/㎣以上 ・総ビリルビン :1.5mg/dl以下 ・AST(GOT)・ALT(GPT):施設上限値(N)×2.5以下(肝転移がある場合(N)×4.0以下) ・血清クレアチニン :各施設の正常値の上限以下 ・Performance Status(ECOG scale):0~1の症例。 6)十分な期間(3ヶ月以上)の生存が期待される症例。 7)年齢:20歳以上の症例。 8)経口摂取可能な症例。 9)登録前2週間以内に心電図検査の結果が正常であることを確認している症例 |
| 除外規準 | 1)スキルス癌 2)前治療としてTS-1またはTaxaneが投与された症例。 3)本試験薬剤の成分に対して過敏症の既往歴のある症例。 4)TXT又はTS-1の投与禁忌である症例。 5)フッ化ピリミジン系抗真菌剤(フルシトシン)投与中の症例。 6)ステロイドの継続投与症例。 7)感染症を合併している症例、38℃以上の発熱を有し感染症を疑われる症例。 8)重篤な合併症を有する症例。 ・ 心疾患(うっ血性心不全)やコントロール不良の狭心症および不整脈を有する症例。 ・ 3ヶ月以内に心筋梗塞の既往を有する症例。 ・ コントロール困難な糖尿病および高血圧を有する症例。 ・ 間質性肺炎や肺線維症を有する症例。 ・ その他、本試験の施行に重大な支障をきたすと判断される合併症を有する症例。 9)Grade 2以上の末梢神経症状を有する症例(原疾患に由来するものは除く)。 10)排液を必要とする胸水・腹水、および心嚢水貯留を伴う症例。 11)臨床的に脳転移を有する症例。 12)消化管の新鮮出血症例。 13)難治性の下痢(水様便)のある症例。 14)活動性重複癌を有する症例。なお、異時性重複癌に関しては、過去10年以上無再発無治療である症例は登録可とする。 15)妊婦、授乳婦および妊娠の可能性(意思)のある女性。 16)妊娠させる意思のある男性。 17)臨床試験責任医師又は臨床試験分担医師が不適当と判断した症例。 |
| Regimen |
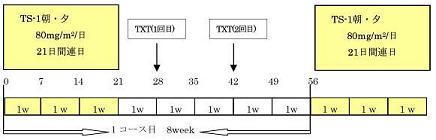
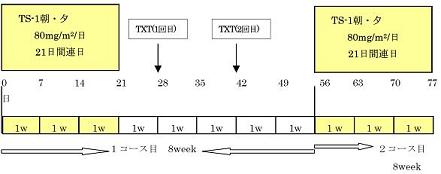
第1相試験:TS-1は80mg/㎡/day x 21日に固定し、TXTはLevel1→4までDLTを指標として増量する。
第2相試験:RDによる同上のデザイン、原則1コース以上、4コースまでの投与を実施
|
| 評価項目 | Phase Ⅰ 主要評価項目:副作用(NCI-CTCに準拠) 副次的評価項目:抗腫瘍効果 Phase Ⅱ 主要評価項目:抗腫瘍効果 副次的評価項目:副作用、延命効果(TTP:time to progression、MST:median survival time) |
| 目標症例数 | 45例 |
| 研究期間 | 2004年5月より2年間 |