臨床試験情報
JACCRO CC-12(研究代表者:中村 将人)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 標準治療に不応/不耐切除不能進行・再発大腸癌に対しFDG-PET/CTを用いてレゴラフェニブの効果予測を検討する第Ⅱ相試験 |
| 研究の目的 | 標準治療に不応/不耐の切除不能進行・再発大腸癌におけるレゴラフェニブ投与後のFDG-PET/CTによる初期変化(投与開始4週後)を観察し、標的病変におけるレゴラフェニブ投与前後のSUVmaxの変化について検討する。 |
| Phase | PhaseⅡ |
| 適格規準 |
以下の規準を全て満たす症例を適格とする。性別は問わない。 1) 白血球数:3,000/mm3以上かつ12,000/mm3以下 ワルファリン、ヘパリンなどの薬剤を使用している患者は血液凝固系検査で異常を示す投与前所見がなければ、本試験への参加が可能である。試験実施施設の基準値に従って、レゴラフェニブ投与開始後にPT-INR値が安定したと判断できるまで、少なくとも週1回の評価を実施すること (11) 本試験内容について十分な説明を受け、本人の文書による同意が得られている症例 |
| 除外規準 |
以下の規準のいずれかに該当する症例は、本試験から除外する。 1) インスリン治療を要する糖尿病症例 (5) レゴラフェニブによる治療歴のある症例 (6) レゴラフェニブの成分に対し過敏症の既往歴のある症例 (7) 登録前4週間以内に拡大照射野放射線療法を受けた症例、または登録前2週間以内に局所放射線療法を受けた症例 (8) 登録前4週間以内に侵襲の大きい手術、切開術による直視下生検、または重大な外傷を受けた症例 (9) 尿蛋白3+を持続的に呈する症例 (10) 避妊する意思のない男性、および、妊婦、授乳婦、妊娠検査陽性の女性または避妊する意思のない女性 (11) その他、試験責任医師または分担医師が本試験への参加を不適当と認めた症例 |
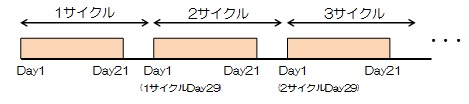
| Regimen |
レゴラフェニブとして1日1回160mgを食後に3週間連日経口投与し、その後1週間休薬する。4週を1サイクルとして投与を繰り返す。
|
| 評価項目 | 主要評価項目 SUVmaxが最も高値を示した病変(主要評価標的部位)の、レゴラフェニブ投与4週後のSUVmax値の変化から見た奏効例の割合 副次評価項目 (1) 高SUVmax値を示した順に最大5つ(各臓器につき最大2つ)までの病変に対する SUVmax値の変化から見た奏効例の割合 (2) 無増悪生存期間(PFS:Progression-Free Survival) (3) 全生存期間(OS:Overall Survival) (4) 奏効率(RR:Response Rate) (5) 病勢コントロール率(DCR:Disease Control Rate) (6) SUVmaxの変化率とOSおよびPFSとの関連 (7) 有害事象 |
| 目標症例数 | 20例 |
| 研究期間 | 登録期間:2014年11月~2016年10月 追跡期間:最終症例登録終了後1年間 試験期間:3年 |