臨床試験情報
JACCRO CC-08(研究代表者:辻 晃仁)
| 項目 | 説明 |
|---|---|
| 研究課題名 | 抗EGFR抗体薬セツキシマブ投与歴のあるKRAS遺伝子野生型の切除不能進行・再発大腸癌に対する三次治療におけるセツキシマブ再投与の第Ⅱ相試験 |
| 研究の目的 | 一次治療のセツキシマブ併用療法でClinical Response(CR、PRの症例、またはSDが6か月以上持続した症例)となったKRAS遺伝子野生型の切除不能進行・再発大腸癌に対して、三次治療におけるセツキシマブ再投与の有効性と安全性を検証する。 |
| Phase | PhaseⅡ |
| 適格規準 | (1) 組織学的に大腸癌であることが確認された症例 (2) KRAS遺伝子野生型の症例 (3) 一次治療におけるセツキシマブの投与(併用レジメンは問わない)でClinical Response を得られた症例(CR、PRの症例、または SDが6か月以上持続した症例) (4) 切除不能進行・再発大腸癌の一次治療でオキサリプラチン、二次治療でイリノテカンが投与さ れた症例、あるいは一次治療でイリノテカン、二次治療でオキサリプラチンが投与された症例 (5) 抗EGFR抗体薬、レゴラフェニブ以外の二次治療が実施されている症例 (6) RECIST(Ver.1.1)に基づく評価可能病変を有する症例 (7) ECOGのPerformance Status(PS)が0~2の症例 (8) 同意取得時の年齢が20歳以上の症例 (9) 3か月以上の生存が見込まれる症例 (10) 登録前14日以内の主要臓器機能について、以下の規準を満たしている症例 1) 白血球数 3,000/mm3以上、12,000/mm3以下 2) 好中球数 1,500/mm3以上 3) 血小板数 10.0×104/mm3以上 4) ヘモグロビン 9.0g/dL以上 5) 血中ビリルビン 2.0mg/dL以下 6) AST 100IU/L(肝転移を有する場合は300IU/L)以下 7) ALT 100IU/L(肝転移を有する場合は300IU/L)以下 8) 血清クレアチニン 1.5mg/dL以下 (11) 本試験内容について十分な説明を受け、本人の文書による同意が得られている症例 |
| 除外規準 | (1) 同時性重複がんまたは無病期間が5年以内の異時性重複がんを有する症例 (2) 症状を有する脳転移症例 (3) 重篤な感染症を有する症例【イリノテカン投与禁忌】 (4) 間質性肺炎あるいは肺線維症またはその既往を有する症例【イリノテカン投与禁忌】 (5) 重篤な心疾患またはその既往を有する症例 (6) 機能障害を伴う重度の感覚異常または知覚不全のある症例 (7) 多量の癌性体腔液(胸水、腹水、心嚢水)を有する症例【イリノテカン投与禁忌】 (8) 重篤な併存疾患(腎不全、肝不全、高血圧など)を有する症例 (9) 原発巣または転移巣に対して放射線治療が施行された症例 (10) 避妊する意思のない男性、および、妊婦、授乳婦、妊娠検査陽性の女性または避妊する意思のない女性 (11) その他、試験責任医師または分担医師が本試験への参加を不適当と認めた症例 |
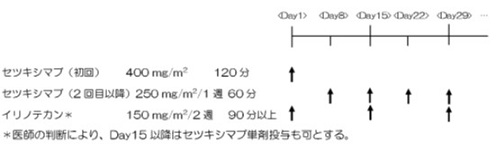
| Regimen |
以下のプロトコール治療を症例登録後21日以内に開始する。
|
| 評価項目 | 主要評価項目:3か月間無増悪生存確率 副次評価項目:奏効率(RR) 病勢コントロール率(DCR) 全生存期間(OS) 無増悪生存期間(PFS) 治療成功期間(TTF) 安全性(有害事象の発現率とその重症度) |
| 目標症例数 | 35例 |
| 研究期間 | 登録期間:2013年5月~2016年4月(3年間) ※2015年11月に症例登録終了 追跡期間:最終症例登録終了後1年間 試験期間:2013年5月~2017年4月(4年間) |