臨床試験情報
JACCRO CC-01(研究代表者:固武健二郎)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 進行・再発大腸癌に対するTS-1/CPT-11併用療法の第II相臨床試験 |
| 研究の目的 | 進行・再発大腸癌に対するTS-1/CPT-11の推奨用量における有効性および安全性を検討する。 |
| Phase | PhaseⅡ |
| 適格規準 | 1) 原発巣あるいは転移巣からの組織診で大腸癌であることが確認されている患者 2) 切除不能な初発癌または再発癌患者 3) 測定可能病変が客観資料で確認されている患者 4) 前治療として、TS-1およびCPT-11が用いられていない患者。TS-1またはCPT-11以外の薬剤の前治療がある場合は、投与終了後28日間以上経過している患者 5) 放射線療法の治療歴がない患者 6) 登録時の年齢が20歳以上75歳未満の患者。12週間以上の生存が期待できる患者。 7) Performance status (ECOG基準)が0または1の患者 8) 主要臓器(骨髄,肺,肝,腎など)に高度な障害がなく,かつ少なくとも投与前14日以内の臨床検査値が以下の基準をすべて満たす患者 白血球数 4,000 ~12,000/mm3 好中球数 2,000/mm3以上 血小板数 100,000/mm3以上 血色素 9.5g/dl以上 GOT(AST)・GPT(ALT) 100IU/l以下 総ビリルビン 1.5㎎/dl以下 血清クレアチニン 施設基準値以下 腎機能検査(または)クレアチニンクリアランス 51ml/min以上 9) 経口薬の内服ができる患者 10) 本人から文書による同意が得られている患者 |
| 除外規準 | 1) 重篤な薬剤過敏症,薬物アレルギーの既往を有する患者 2) 臨床上問題となる感染症を有する患者 3) 下痢(水様便)を有する患者 4) 腸管麻痺,腸閉塞を有する患者 5) 胸部レントゲンで明らかな間質性肺炎または肺線維症を有する患者 6) フルシトシンを投与中である患者 7) 活動性の重複癌を有する患者 8) コントロール困難な糖尿病を有する患者 9) 重篤な心疾患を有する患者 10) 標的病変に対する放射線療法を実施している、または予定している患者 11) 臨床上問題となる精神・神経疾患等により,本試験への登録が困難と判断される患者 12) 妊娠中,授乳中の女性または授子希望者 13) 治療を要する体腔液貯留を有する症例(チューブドレナージあるいは穿刺による排液を要すると判断される症例) 14) その他,担当医師等が本試験を安全に実施するのに不適当と判断したもの |
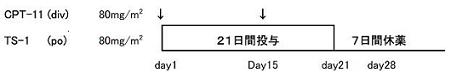
| Regimen | 4週を1コースとし、プロトコール治療の中止基準に該当しない限り、最低2コース治療を継続する。コース数の上限は設定しない。 |
| 評価項目 |
5主要評価項目: 奏効率 (response rate)
|
| 目標症例数 | 50例 |
| 研究期間 | 2005年1月から2年間 |