臨床試験情報
JACCRO BC-03(研究代表者:伊藤 良則)
| 項目 | 説明 |
|---|---|
| 試験課題名 | ホルモン受容体陽性、HER2陰性進行再発乳癌に対するエリブリンDay1、Day8投与3サイクル施行後、隔週投与による維持療法の第Ⅱ相試験 |
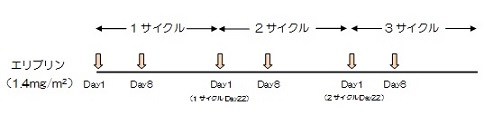
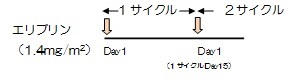
| 研究の目的 | ホルモン受容体陽性、HER2陰性進行再発乳癌の症例を対象として、エリブリンDay1、Day8投与3サイクル(週1回2週連続投与、3週目休薬)を施行した後、エリブリン隔週投与に切り替えた場合の有効性と安全性を評価する。 |
| Phase | PhaseⅡ |
| 対象疾患/選択基準 | (1) 組織学的に診断された浸潤性乳癌の女性の症例 (2) 原発巣または転移巣の癌浸潤部におけるホルモン受容体陽性、HER2陰性が確認されている症例 (3) 同意取得時の年齢が20歳以上の症例 (4) ECOGのPerformance Status(PS)が0~2の症例 (5) 遠隔転移を有する乳癌、もしくは切除不能局所進行乳癌(StageⅢB/ⅢC、乳癌取扱い規約第17版)の症例 (6) 前化学療法としてアンスラサイクリン系抗癌剤およびタキサン系抗癌剤を含む化学療法が施行された症例 (7) 有症状の脳転移がない症例(脳転移に対する放射線治療後または手術後であっても、登録時に無症状であれば登録可能) (8) 以下の規準のうち、いずれか1つを満たしている症例 1) 脳転移以外にRECIST(Ver1.1)で規定する測定可能病変を有する症例(放射線治療の実施部位は評価可能病変としない) 2) 測定不能な溶骨型骨病変を有する症例 3) 測定不能な混合型骨病変を有する症例 (9) 登録前14日以内の主要臓器機能について以下の規準を満たしている症例 1) 好中球数 1,500/mm3以上 2) 血小板数 7.5×104/mm3以上 3) ヘモグロビン 9.0g/dL以上 4) AST 100IU/L以下(肝転移を有する症例は、200IU/L以下) 5) ALT 100IU/L以下(肝転移を有する症例は、200IU/L以下) 6) 血中ビリルビン 1.5mg/dL以下 7) クレアチニン 1.5mg/dL以下 8) 末梢性感覚ニューロパチー Grade2以下 9) 末梢性運動ニューロパチー Grade2以下 10) 脱毛、疲労、倦怠感を除く非血液毒性 Grade1以下 (10) 3か月以上の生存が見込まれる症例 (11) 本試験内容について十分な説明を受け、本人の文書による同意が得られている症例 |
| 除外規準 | (1) 活動性の重複癌(同時性重複癌および無病期間が5年以内の異時性重複癌)を有する症例。ただし、局所治療により治癒と判断されるCarcinoma in situ(上皮内癌)もしくは粘膜内癌相当の病変は除外しない。 (2) 重篤な感染症を有する症例 (3) 以下の重篤な合併症を有する症例 1) 治療によりコントロール不良な虚血性心疾患、不整脈などの心疾患を認める(高血圧に伴う左室肥大や軽度の左室負荷、軽度の右脚ブロックなどを除く) 2) 6か月以内に心筋梗塞の発症を認める 3) 肝硬変の合併を認める 4) 活動性の肝炎を認める 5) 間質性肺炎、肺線維症を認める 6) 出血傾向を認める (4) 脳転移の治療としてステロイドを投与している症例、または癌性髄膜炎を有する症例 (5) 重篤な過敏症の既往を有する症例 (6) 転移・再発乳癌の前化学療法としてエリブリンが投与されている症例 (7) 臨床上問題となる精神疾患により本試験への登録が困難と判断される症例 (8) 妊婦、授乳婦、現在妊娠している可能性がある症例、または避妊する意思がない症例 (9) その他、試験責任医師または分担医師が本試験への参加を不適当と認めた症例 |
| Regimen |
以下のプロトコール治療を症例登録後14日以内に開始する。
≪維持療法≫
|
| 評価項目 | 主要評価項目: 維持療法に移行出来た症例の無増悪生存期間(Progression-free Survival:PFS) 副次評価項目: (1) 維持療法に移行出来た症例の全生存期間(Overall Survival:OS) (2) 維持療法に移行出来た症例の治療成功期間(Time to Treatment Failure:TTF) (3) 維持療法に移行出来た症例の奏効率(Response Rate:RR) (4) 解析対象症例の無増悪生存期間(PFS) (5) 解析対象症例の全生存期間(OS) (6) 解析対象症例の治療成功期間(TTF) (7) 解析対象症例の奏効率(RR) (8) 維持療法の安全性(有害事象の発現割合とその重症度) (9) 導入療法+維持療法の安全性(有害事象の発現割合とその重症度) |
| 目標症例数 | 40例(維持療法に移行出来た症例) |
| 研究期間 | 登録期間:2014年5月~2017年10月 追跡期間:最終症例登録後2年 試験期間:2014年5月~2019年10月 |