
臨床試験情報
JACCRO BC-01(研究代表者:徳田裕)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 局所進行乳癌に対するCEF followed by Weekly Paclitaxel術前化療多施設共同臨床試験 |
| 研究の目的 | 乳癌の術前化療において、現在最も高い病理学的 CR (pCR) が期待しうる治療法としてCEF followed by Weekly Paclitaxel 療法を考え、同療法の治療効果(pCR率)、安全性、feasibility を検証する。また、乳癌細胞の遺伝子発現パターンをcDNA microarray (DNA chip) を用いて網羅的に把握し、化学療法の治療効果との関連性について解析し、pCR予知指標としての遺伝子発現パターンを明らかにする。また、副作用、薬物代謝とSNPsとの関連性について解析する。それによって、癌の個性に則した最適の乳癌化学療法体系(オーダーメイド治療)を構築する端緒とする。 |
| Phase | PhaseⅡ |
| 適格規準 | 1)組織学的に乳癌であることが確認されている浸潤径(T)≧3cmのStage IIA~Stage IIIB の原発性乳癌症例。 2)手術可能であること。 3)年齢は70歳未満であること。 4)PSは0~1であること。 5)6月以上の生存が期待し得ること。 6)登録時(登録の2週間以内)に臨床検査所見で下記のすべてを満たすもの。 WBC≧4,000/mm3 または Granulocyte≧2,000/mm3かつWBC<10,000/mm3 Platelet≧100,000/mm3、Hemoglobin≧10g/dl、Creatinine≦1.2mg/dl、T.Bilirubin≦1.5mg/dl、GOT/GPT ≦施設基準値の2倍以内 7)左室駆出率(LV ejection fraction: LVEF)が50%以上である。 8)文書にて自由意志による本人の同意が得られている。 |
| 除外規準 | 1)非浸潤癌、または微小浸潤癌minimal invasive cancer。 2)Stage IV乳癌、炎症性乳癌、男性乳癌。 3)妊娠・授乳期乳癌。妊娠を希望する患者、または妊娠または妊娠している可能性がある。 4)化学療法、内分泌療法、放射線照射などの前治療歴がある。 5)活動性の重複癌を有する(非浸潤癌、治療後5年以上の無病期間を経過しているものは非活動性とみなす)。 6)感染症、または感染症の疑いがある。 7)重篤な心疾患またはその既往がある。 8)コントロール不良の糖尿病がある。 9)治療を要する浮腫がある。 10)その他の重篤な合併症がある。 11)治療に支障をきたすおそれのある薬剤アレルギー既往歴がある。 12)その他、担当医が対象として不適当と判断したもの。 |
| Regimen | 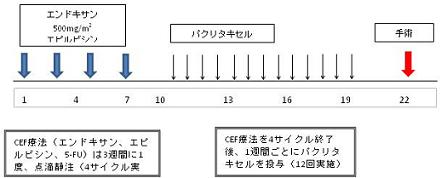 |
| 評価項目 | 主評価項目…病理学的CR率 副評価項目…1) 安全性・feasibility、2) 乳房温存率、3) 癌細胞の遺伝子発現パターンおよびSNPsと治療効果との関連性、4) SNPsと毒性ならびに臨床薬理学的特性との関連性 |
| 目標症例数 | 60例 |
| 研究期間 | 2003年10月から3年間 |

