臨床試験情報
JACCRO GC-06(研究代表者:瀧内 比呂也)
| 項目 | 説明 |
|---|---|
| 試験課題名 | HER2陽性・65歳以上の進行再発胃癌に対するティーエスワン+トラスツズマブ併用療法の第II相試験 |
| 研究の目的 | HER2陽性の測定可能病変を有する65歳以上の進行再発胃癌を対象とし、ティーエスワン+トラスツズマブ併用療法の有効性と安全性を検討する。 |
| Phase | 第II相試験 |
| 適格規準 | 1)組織学的に腺癌であることが確認された、切除不能または再発の胃癌症例。なお、食道胃接合部の上下2cm以内に腫瘍の中心部がある食道胃接合部癌は可とする。 2)RECIST version 1.1に基づく測定可能病変を有する症例。 3)原発巣または転移巣においてHER2陽性(IHC3+、もしくはIHC2+かつFISH陽性)と診断されている症例。 4)同意取得時の年齢が65歳以上の症例。 5)Performance Status(ECOG)が0~2の症例。 6)進行・再発胃癌に対して化学療法および放射線療法が施行されていない症例。ただし、補助化学療法の場合は治療終了から再発までの期間が6か月を超えている症例は登録可とする。 7)登録前14日以内(登録日2週間前の同一曜日の検査は可)の検査により、以下の主要臓器機能が確保されている症例。 ① 白血球数: 3,500 /mm3以上12,000 / mm3未満 ② 好中球数: 2,000 / mm3以上 ③ 血小板数: 10.0 × 104 / mm3以上 ④ ヘモグロビン: 8.0 g/dL以上 ⑤ AST: 100 IU/L未満 ⑥ ALT: 100 IU/L未満 ⑦ 血中ビリルビン: 1.5 mg/dL未満 ⑧ 血清クレアチニン:1.2 mg/dL 以下 ⑨ クレアチニンクリアランス:50 ml/min以上※1※2 ※1: Cockcroft-Gault の推定式を用いるが、24時間実測値がある場合は実測値を優先させる。 ※2: クレアチニンクリアランスが50 ml/min以上、60ml/min未満の場合、「表7.2.1. ティーエスワンの1日投与量」に従い、ティーエスワンの初回1日投与量を1段階減量すること。 8)登録前21日以内に、心エコー、もしくはMUGAスキャンを考慮して算出した左室駆出率(LVEF)が50%以上の症例。 9)登録前21日以内の12誘導心電図で、臨床的に問題となる異常所見がない症例。 10)経口摂取可能な症例。 11)登録日より3か月以上の生存が期待される症例。 12)病名告知を受けた本人より文書にて同意が得られた症例。 |
| 除外規準 | 1)同時性重複がんまたは無病期間が5年以内の異時性重複がんを有する症例(ただし、粘膜内癌の病変は活動性重複がんとはしない)。 2)多量の癌性体腔液(胸水、腹水、心嚢水)を有する症例。 3)明らかな脳転移を有する症例。 4)胃癌もしくは消化管潰瘍からの出血を有する症例。 5)38.0℃以上の発熱を伴う感染症を有する症例。 6)HBs抗原陽性の症例。 7)うっ血性心不全の既往歴を有する症例。 8)薬物療法を必要とする狭心症を有する症例。 9)心電図上、壁内心筋梗塞が明確に認められる症例。 10)コントロール不十分な高血圧(収縮期血圧>180mmHg又は拡張期血圧>100mmHg)を有する症例。 11)臨床上明らかな心臓弁膜症を有する症例。 12)ハイリスクなコントロール不能の不整脈を有する症例。 13)重篤な合併症(間質性肺炎又は肺線維症、心不全、腎不全、肝不全、コントロール不良の糖尿病など)を有する症例。 14)安静時呼吸困難を有する症例。 15)下痢(1日4回以上または水様便)を有する症例。 16)ティーエスワン、トラスツズマブの投与禁忌である症例(最新の添付文書参照)。 17)ティーエスワン、トラスツズマブに過敏症の既往歴を有する症例。 18)フルシトシンを投与中の症例。 19)フェニトインまたはワルファリンカリウムを継続的に投与中の症例。 20)長期間又は高用量のステロイド剤療法を受けている症例。 21)妊婦あるいは妊娠している可能性のある女性。パートナーの妊娠を希望する男性。 22)試験責任医師または分担医師が本試験への参加を不適当と判断した症例。 |
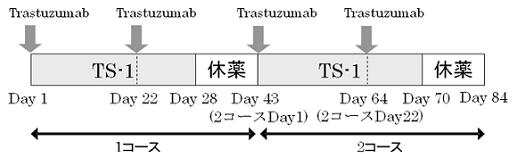
| Regimen |
プロトコール治療の中止規準のいずれかに該当するまで投与を繰り返す。
|
| 評価項目 | 主要評価項目 : 奏効率 副次評価項目 : 全生存期間 無増悪生存期間 治療成功期間 有害事象の発現頻度と程度 |
| 目標症例数 | 目標症例数: 40例 |
| 研究期間 | 症例集積期間 : 2012年3月~2014年2月 追 跡 期 間 : 最終症例登録後2年間 研 究 期 間 : 2012年3月~2016年2月 |