臨床試験情報
JACCRO CC-04(研究代表者:渡邉 聡明)
| 項目 | 説明 |
|---|---|
| 試験課題名 | 局所進行直腸癌に対する術前TS-1+Oxaliplatin+放射線併用療法の第Ⅰ/Ⅱ相試験 |
| 研究の目的 | 切除可能な局所進行直腸癌症例を対象として、TS-1+Oxaliplatin と放射線照射による術前化学放射線療法を行い、第Ⅰ相試験では TS-1 と Oxaliplatin の最大耐用量(MTD : maximum tolerated dose)と推奨用量(RD : recommended dose)を決定する。第Ⅱ相試験では、第Ⅰ相試験で得られた推奨用量による治療を行い有効性と安全性を評価する。 |
| Phase | 第Ⅰ/Ⅱ相試験 |
| 適格規準 | 1) 主占居部位がRaまたはRbである症例 2) 組織型が腺癌(tub1/tub2)であることが確認されている症例 3) MDCTおよびMRIを用いた術前診断にてT3~4(any N)と診断されている症例(TNM分類, UICC第7版, 2009) 4) R0切除が可能であると診断されている症例 5) 遠隔転移のない症例 6) 同意取得時年齢 ・第Ⅰ相試験:20歳以上75歳以下の症例 ・第Ⅱ相試験:20歳以上80歳以下の症例 7) Performance Status(ECOG)が0、1の症例 8) 前治療として放射線療法、化学療法、ホルモン療法などが施行されていない症例 9) 登録前14日以内(登録2週間前の同一曜日の検査は可)のデータにより、以下の主要臓器機能が保持されている症例 ① 白血球数 ≧4,000 /mm3 かつ ≦12,000 /mm3 ② 好中球数 ≧2,000 /mm3 ③ 血小板数 ≧10.0×104 /mm3 ④ ヘモグロビン ≧9.0 g/dL ⑤ AST(GOT) ≦100 IU/L ⑥ ALT(GPT) ≦100 IU/L ⑦ 血中ビリルビン ≦1.5 mg/dL ⑧ クレアチニンクリアランス ≧60.0 mL/min* *24時間蓄尿によるクレアチニンクリアランスを実測した場合は、その値を用いる。 実測値がない場合は、以下のCockcroft-Gault推定式を用いて推定値を算出する。 男性:クレアチニンクリアランス=体重×(140-年齢)/(72×血清クレアチニン値) 女性:クレアチニンクリアランス=0.85×{体重×(140-年齢)/(72×血清クレアチニン値)} 10) 食事摂取可能で薬剤の経口投与が可能な症例 11) 試験参加について患者本人から文書にて同意が得られている症例 |
| 除外規準 | 1) 重篤な薬剤過敏症の既往歴を有する症例 2) 骨盤腔に対し放射線治療の既往を有する症例 3) 38.0℃以上の発熱をともなう感染症を有する症例 4) 重篤な併存疾患(間質性肺炎又は肺線維症、コントロール不良な糖尿病、腎不全、肝不全など)を有する症例 5) 著しい心電図異常が認められる症例、または臨床上問題となる心疾患(心不全、心筋梗塞、狭心症)を有する症例 6) 感覚性の神経障害を有する症例 7) 重篤な下痢(水様便)のある症例(ただし直腸癌による便通異常としての下痢は除く) 8) 症状緩和のために穿刺が必要と考えられる胸水・腹水が貯留している症例 9) 同時性多重がんまたは無病期間が5年以内の異時性多重がんを有する症例(ただし局所治療で治癒が見込める早期がんは除外とはしない) 10) 妊娠の可能性(意思)のある女性、妊婦または授乳婦 11) 挙児希望のある男性 12) フルシトシンを投与中の症例【TS-1の投与禁忌】 13) その他、試験責任医師または分担医師が本試験の登録に不適当と判断した症例 |
| Regimen |
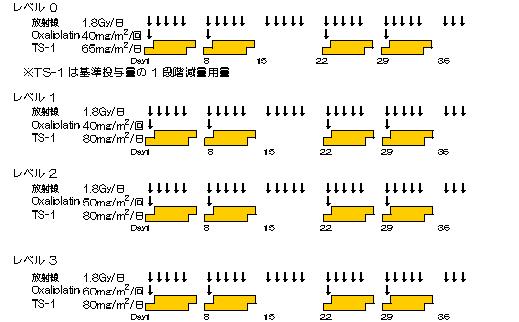
化学放射線療法 治療スケジュール ≪第Ⅰ相試験≫
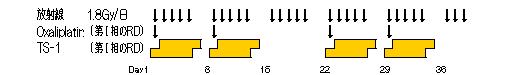
≪第Ⅱ相試験≫
第Ⅰ相試験、第Ⅱ相試験ともに、化学放射線療法終了・中止後6~10週以内に手術を実施する。 |
| 評価項目 |
第Ⅰ相試験 副次評価項目 : ① R0切除率 |
| 目標症例数 |
第Ⅰ相試験:各レベル3~6例(最大18例) 第Ⅱ相試験:45例(第Ⅰ相試験のRDレベルの症例を含む) |
| 研究期間 | 2010年9月~2016年8月(予定) |